Este artículo se publicó hace 3 años.
Vacuna contra la covid-19La Comisión Europea autoriza la vacuna de AstraZeneca en medio de la polémica por sus envíos
La Agencia Europea del Medicamento había dado luz verde al uso condicional de la vacuna solo para los mayores de 18 años. También autoriza su inyección en los mayores de 55, pese a las dudas de los resultados en esa franja de edad.
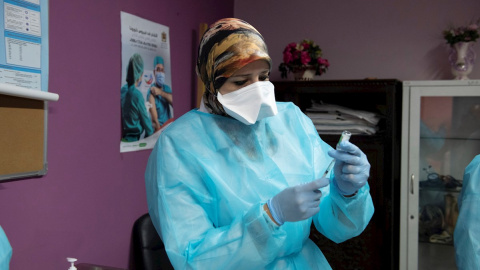
Ámsterdam (Países Bajos)--Actualizado a
La Comisión Europea ha autorizado este viernes la comercialización en toda la UE de la vacuna desarrollada por AstraZeneca y la Universidad de Oxford, que horas antes había recibido el visto bueno técnico por parte de la Agencia Europea del Medicamento (EMA). Esta aprobación la convierte en la tercera vacuna, por detrás de las de Pfizer/BioNTech y Moderna, en poder ser comercializada en la Unión Europea en la lucha contra el coronavirus.
"La vacuna de AstraZeneca ha sido autorizada por la Comisión Europea", ha anunciado en la red social Twitter la comisaria de Salud, Stella Kyriakides.
La Unión Europea se reservó el acceso a 300 millones de dosis de la vacuna de AstraZeneca y Oxford (y la posibilidad de adquirir otros 100 millones más), pero la farmacéutica anunció la semana pasada que sólo podría entregar un cuarto de las dosis prometidas para el primer trimestre por problemas de producción.
"Esperamos que la compañía suministre los 400 millones de dosis como acordamos. Seguiremos haciendo todo lo que podemos para garantizar vacunas para los europeos y nuestros vecinos y socios del mundo", ha escrito en la misma red social la jefa del Ejecutivo comunitario, Ursula von der Leyen.
Esta misma tarde, la Agencia Europea del Medicamento ha dado luz verde al uso condicional de la vacuna, aunque solo para los mayores de 18 años, al considerar que no hay evidencias de su eficacia por debajo de esa edad.
Según los expertos de la EMA, “no hay razones para pensar que esta vacuna no sea efectiva contra las mutaciones” que ha sufrido el SARS-CoV-2, como la nueva cepa británica, aparentemente más contagios que las variantes anteriores del coronavirus, aunque la agencia prometió “seguir analizando esta cuestión” en las próximas semanas.
El CHMP ha llegado a esta conclusión positiva a partir de los resultados combinados de cuatro ensayos clínicos, con unos 24.000 participantes en total, llevados a cabo en Reino Unido, Brasil y Sudáfrica, y que mostraron que la vacuna de AstraZeneca es “segura y eficaz” para prevenir el covid-19 en adultos.
Sin estudios en mayores de 55 años
La EMA subrayó que gran parte de los participantes en los estudios clínicos analizados tenían entre 18 y 55 años, por lo que “no hay suficientes resultados entre los voluntarios mayores de 55 años como para dar una cifra sobre cómo funciona la vacuna en este grupo”, pero señaló que “se espera que proteja" porque la vacuna es segura, pero no dice cuan eficaz es a partir de esa edad.
No obstante, la EMA subrayó que espera más información de otros estudios clínicos en curso, que incluyen voluntarios de “edad avanzada” en una proporción suficiente como para sacar conclusiones sobre el porcentaje de eficacia.
La segunda dosis, entre 4 y 12 semanas después
Este antídoto, que demostró una eficacia de alrededor del 60% en los ensayos clínicos analizados, se tendrá que administrar en dos dosis estándar, y la segunda inyección deberá ponerse entre 4 y 12 semanas después de la primera.
“Con esta tercera opinión positiva, hemos ampliado aún más el arsenal de vacunas disponibles para los estados miembros de la UE y el Espacio Económico Europeo (EEE) para combatir la pandemia y proteger a sus ciudadanos”, explicó la directora ejecutiva de la EMA, Emer Cooke.
Subrayó que, como con Pfizer y Moderna, el CHMP ha evaluado “rigurosamente” la vacuna de AstraZeneca, y defendió que “la base científica” del trabajo de la EMA respalda su “firme compromiso de salvaguardar la salud de los ciudadanos” de la UE.
La UE publica el contrato con AstraZeneca
Precisamente este viernes, la Unión Europea ha decidido hacer público el contrato con Astrazeneca, ocultando eso sí el precio final que ha pagado por las vacunas, la cantidad total y los plazos de entrega.
El Ejecutivo comunitario había solicitado formalmente a la empresa su luz verde a la publicación del acuerdo como símbolo de transparencia, pero no ha sido así. La parte del contrato que determina los términos de entrega, distribución y almacenaje, que han sido cuestiones principales de disputa, también están ocultas, mientras que las cantidades, plazos y condiciones de las dosis siguen siendo una incógnita.
El anuncio llega en una semana cargada de tensión entre ambas partes después de que AstraZeneca anunciara que no podrá entregar las dosis prometidas a los Estados miembros para el primer trimestre por problemas en una planta de producción.
A esta agria disputa se suma la surgida entre Reino Unido y la Unión Europea en torno al suministro de vacunas covid. Su contrato con la farmacéutica recoge que las dosis solo pueden ser enviadas desde las plantas de producción británicas a Europa una vez que Inglaterra haya recibido los 100 millones de dosis que había ordenado.
La Unión Europea, que reservó el acceso a 300 millones de dosis y la opción de acceder a otros 100 millones más, rechazó este jueves este orden de prioridad exigiendo a la farmacéutica que enviara las dosis que se habían pactado como sea y desde donde sea.


Comentarios de nuestros suscriptores/as
¿Quieres comentar?Para ver los comentarios de nuestros suscriptores y suscriptoras, primero tienes que iniciar sesión o registrarte.